Effekt & säkerhet


Studiedesign
Robust studiedesign med mer än 2,600 patienter i två kliniska fas III-prövningar ¹,²
Studiedesign: ZEPOSIA® utvärderades i två randomiserade, dubbelblinda, dubbel-dummy, aktivt kontrollerade kliniska fas III-studier med parallellgrupp med liknande utformning och effektmått, hos patienter med skovvis förlöpande MS (RRMS). I studierna inkluderades sammanlagt mer än 2,600 patienter från 150 centra i över 20 länder.¹,² Studie 1, SUNBEAM, var en 1-årig studie i vilken patienterna fortsatte med den tilldelade behandlingen över 12 månader till dess att den patient som sist inkluderats slutfört studien1. Studie 2, RADIANCE, var en 2-årig studie.²
Dosen av ZEPOSIA® var 0,92 mg (godkänd som underhållsdos) och 0,46 mg som gavs oralt, med en startdos på 0,23 mg under dag 1–4, följt av en upptrappning till 0,46 mg under dag 5–7, följt av den tilldelade dosen från och med dag 8. Dosen av Avonex (interferonbeta 1-a), den aktiva komparatorn, var 30 mikrogram och gavs intramuskulärt en gång i veckan.¹,²
Grundläggande patientkarakteristika: genomsnittsålder 35,5 år (intervall 18–55 år), 67 % var kvinnor och genomsnittlig tid sedan debut av MS-symtom var 6,7 år. Medianpoängen på EDSS-skalan i början av studien var 2,5. Cirka en tredjedel av patienterna hade fått en sjukdomsmodifierande behandling (disease modifying therapy, DMT), huvudsakligen interferon eller glatirameracetat. Vid studiestart var medelantalet återfall under föregående år 1,3 och 45 % av patienterna hade en eller fler T1-Gd-kontrastladdade lesioner (medelvärde 1,7).¹⁻³
Håll dig uppdaterad med vårt nyhetsbrev!
Anmäl dig gärna till vårt nyhetsbrev som kommer ut ca 5 ggr/år. Du får senaste nytt om ZEPOSIA® samt information kring utbildningstillfällen, t.ex. webinars.
Prenumerera
Läs Tidigare Utskick
Antal inkluderade patienter: 1346
Uppföljningstid: 1 år
Primärt effektmått: årlig skovfrekvens över behandlingstiden
Huvudsakliga sekundära effektmått:
1) antalet nya eller förstorade T2 lesioner vid MR under 12 månader
2) antalet Gadolinium-kontrastladdande lesioner (GdE-lesioner) vid MR vid 12 månader
3) tiden till bekräftad sjukdomsprogress, definierad som en ökning på minst 1 poäng från utgångsvärdet på
EDSS skalan som varade i 12 veckor, bekräftad efter 3 månader och 6 månader.
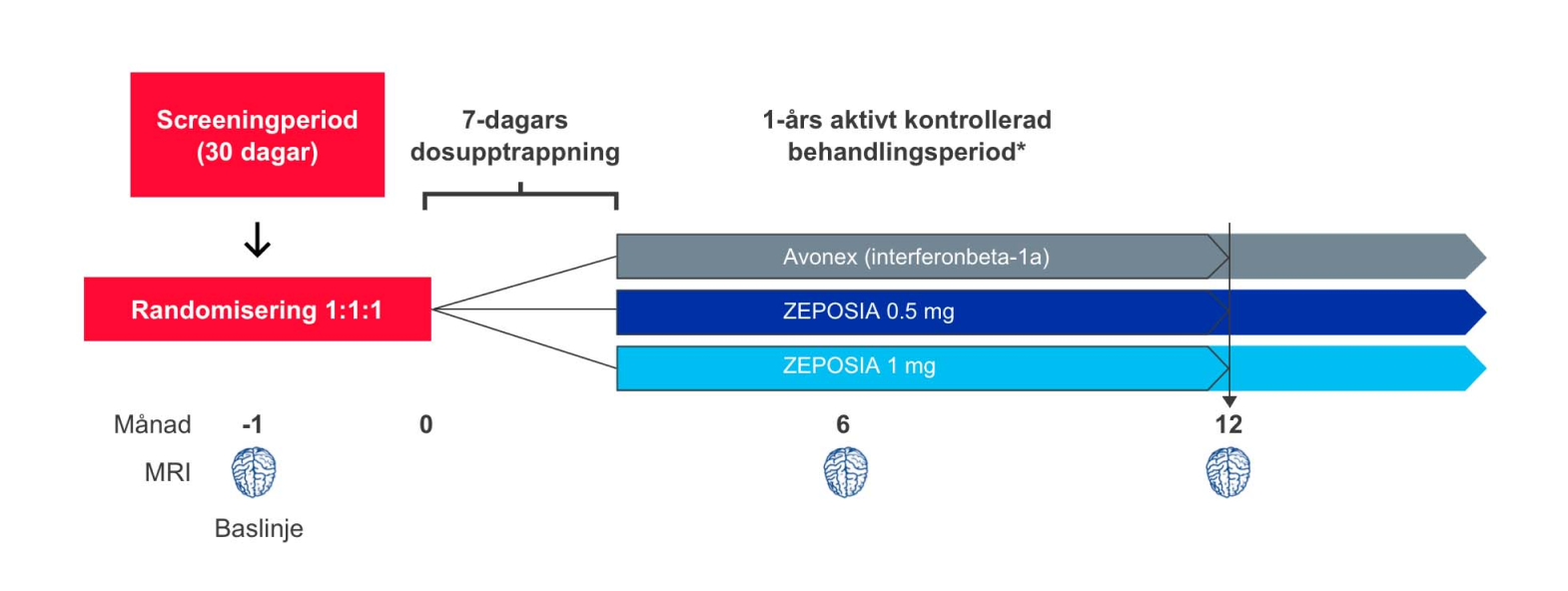
*patienterna fortsatte med den tilldelade behandlingen över 12 månader till dess att den patient som sist inkluderats slutfört studien 1 mg motsvarar 0.92 mg, 0.5 mg motsvarar 0.46 mg
Antal inkluderade patienter: 1320
Uppföljningstid: 2 år
Primärt effektmått: årlig skovfrekvens under 24 månader
Huvudsakliga sekundära effektmått:
1) antalet nya eller förstorade T2 lesioner vid MR under 24 månader
2) antalet Gadolinium-kontrastladdande lesioner (GdE-lesioner) vid MR vid 24 månader
3) tiden till bekräftad sjukdomsprogress, definierad som en ökning på minst 1 poäng från utgångsvärdet på
EDSS skalan som varade i 12 veckor, bekräftad efter 3 månader och 6 månader. Sjukdomsprogress utvärderades prospektivt i en sammanslagen analys av SUNBEAM och RADIANCE.
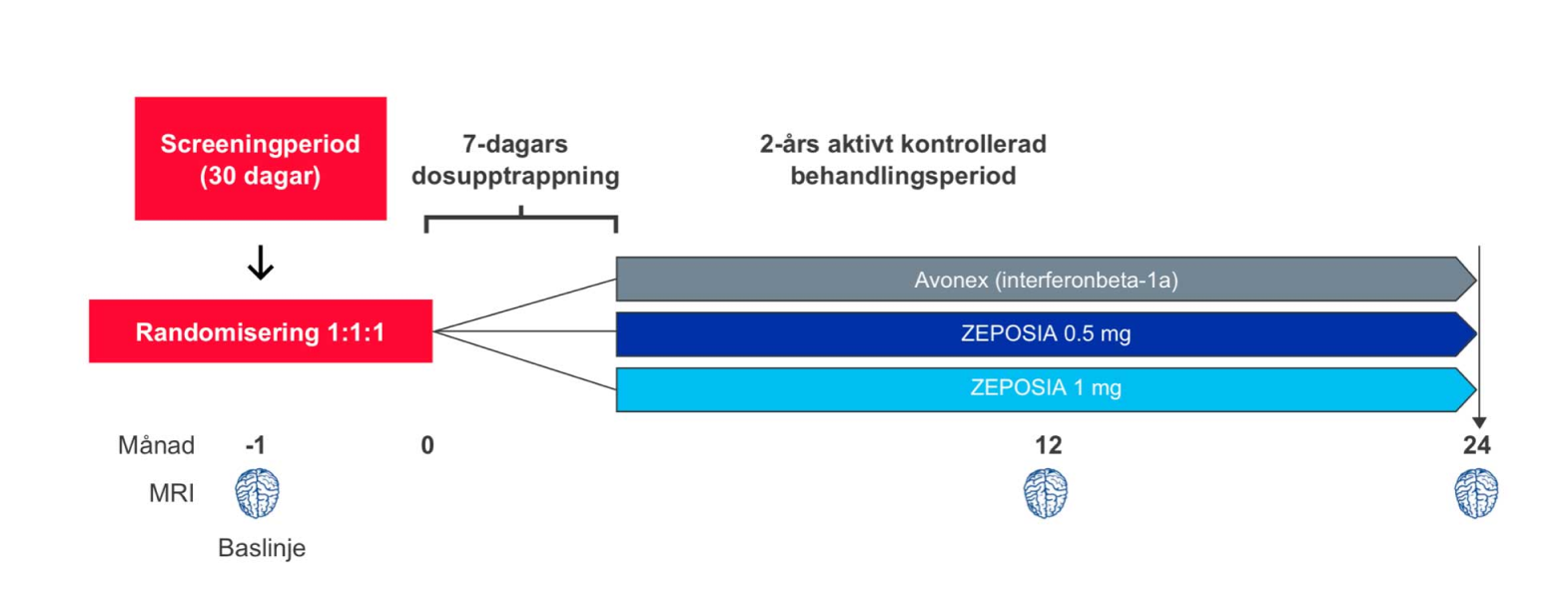
1 mg motsvarar 0.92 mg, 0.5 mg motsvarar 0.46 mg
Effekt
Signifikant bättre effekt än Avonex (interferonbeta 1-a) med avseende på flera effektmått¹⁻³
Signifikant lägre årlig skovfrekvens (ARR) med ZEPOSIA® jämfört med Avonex (interferonbeta-1a)¹,²
I två kliniska head-to-head fas III-studier
Årlig skovfrekvens (ARR)¹,² PRIMÄRT EFFEKTMÅTT
ZEPOSIA® vs. Avonex (interferonbeta-1a)
- 48% i SUNBEAM
- 38% i RADIANCE
I båda kliniska studierna upplevde majoriteten av patienterna inget skov med ZEPOSIA®:
- I SUNBEAM (n=1346) var 78% skovfria efter ett års behandling (vs. 66% med Avonex (interferonbeta-1a))*3
- I RADIANCE (n=1320) var 76% skovfria efter två års behandling (vs. 64% med Avonex (interferonbeta-1a))*3
*p=0,0002 i SUNBEAM-studien och p=0,0012 i RADIANCE-studien, log‑rank‑test. Nominellt p-värde för effektmåtten ej inkluderade i hierarkisk testning och ej justerade för multiplicitet.
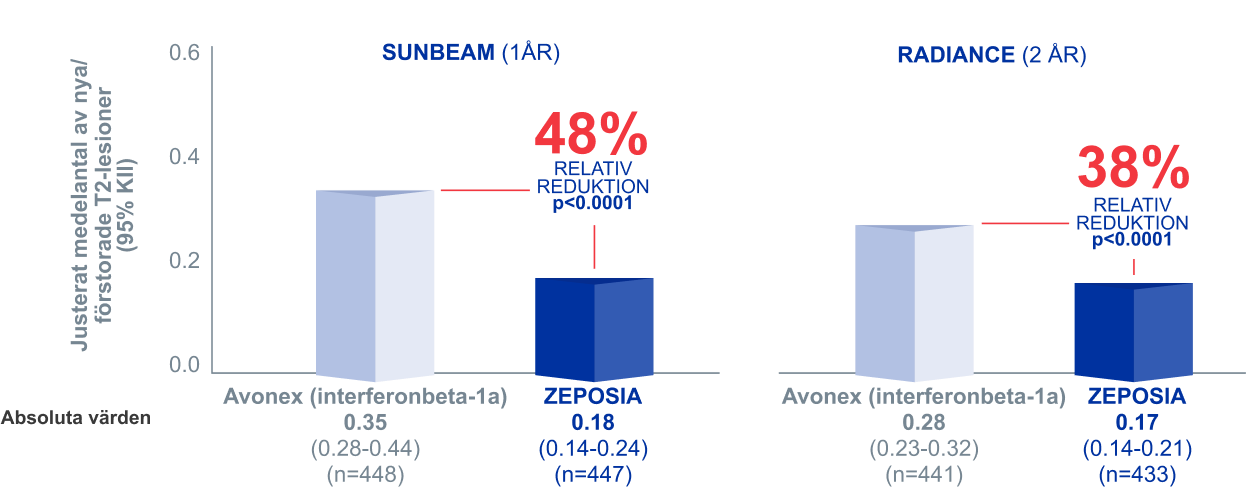
Signifikant färre nya eller förstorade T2-lesioner med ZEPOSIA® jämfört med Avonex (interferonbeta-1a)¹,²
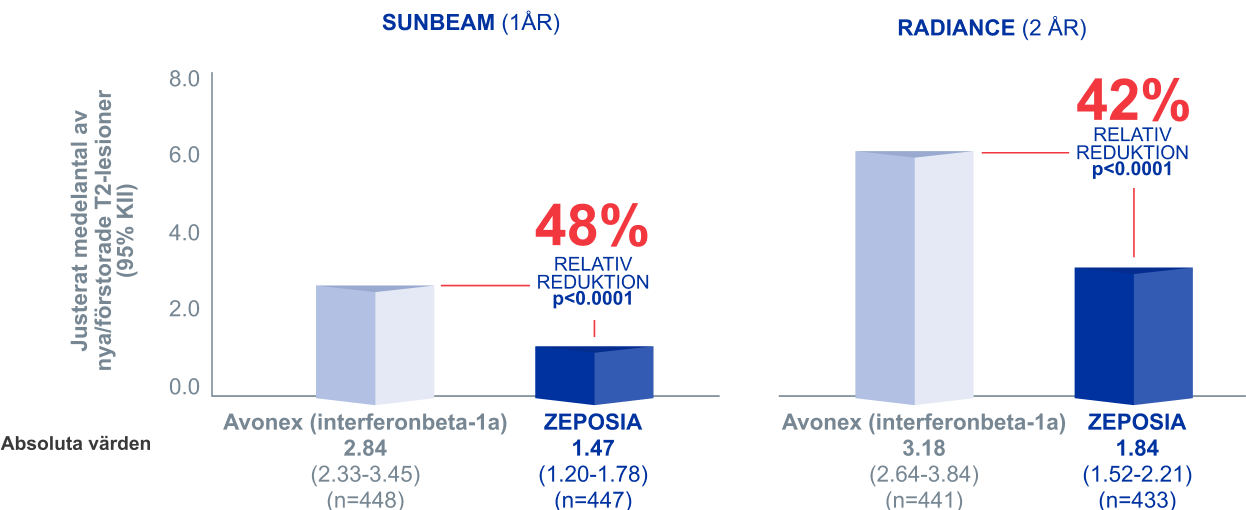
I två kliniska head-to-head fas III-studier
Nya eller förstorade T2-lesioner¹,² SEKUNDÄRT EFFEKTMÅTT
ZEPOSIA® vs. Avonex (interferonbeta-1a)
- 48% i SUNBEAM
- 42% i RADIANCE
Signifikant färre nya eller förstorade GdE-lesioner med ZEPOSIA® jämfört med Avonex (interferonbeta-1a)¹,²
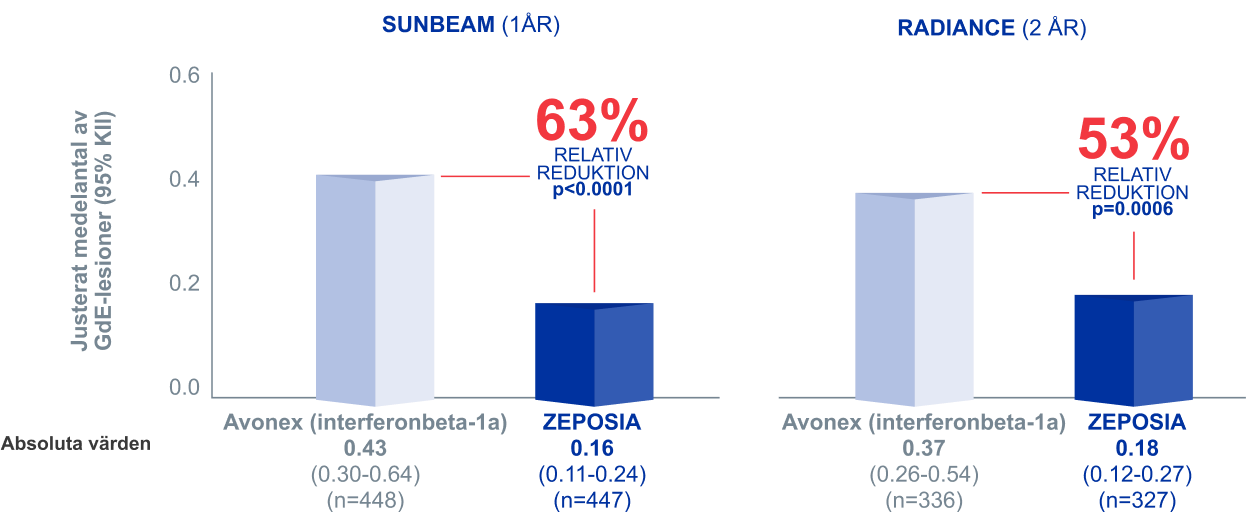
I två kliniska head-to-head fas III-studier
Nya eller förstorade GdE-lesioner¹,² SEKUNDÄRT EFFEKTMÅTT
ZEPOSIA® vs. Avonex (interferonbeta-1a)
- 63% i SUNBEAM
- 53% i RADIANCE

Säkerhet
Säkerhet och tolerabilitet jämförbar med Avonex (interferonbeta-1a) i båda studierna¹,²
Färre behandlingsavbrott på grund av biverkningar, jämfört med Avonex (interferonbeta-1a)*¹,²
Låg frekvens av allvarliga biverkningar, jämförbart med Avonex (interferonbeta 1-a)**¹,²
Låg frekvens av allvarliga infektioner, jämförbart med Avonex (interferonbeta-1a)***¹⁻³
Antalet lymfocyter förblev mestadels strax under det normala värdet under den två-åriga behandlingen****²
*2.9% jämfört med 3.6% i SUNBEAM-studien1 och 3.0% jämfört med 4.1% i RADIANCE-studien2
**2.9% jämfört med 2.5% i SUNBEAM-studien1 och 6.5% jämfört med 6.4% i RADIANCE-studien2
***1% för ZEPOSIA® och 0.8% för Avonex (interferon beta-1a) totalt i både SUNBEAM och RADIANCE
****Ungefärligt genomsnittligt lymfocytantal i blod vid 24 månader var 0,8 x 109/l. Det normala antalet lymfocyter hos vuxna är ca 1 x 109/l till 4.8 1 x 109/l.
Biverkningar som förekom hos ≥2% av patienterna i ZEPOSIA-behandlingsgruppen och med ≥1% högre frekvens än Avonex (interferonbeta-1a)-gruppen¹,²
| SUNBEAM (1ÅR) | RADIANCE (2 ÅR) | |||
| n (%) | Avonex (interferonbeta-1a)(n=445) | ZEPOSIA® (n=448) | Avonex (interferonbeta-1a) (n=440) | ZEPOSIA® (n=434) |
|---|---|---|---|---|
| Nasofaryngit | 36 (8,1 %) | 30 (6,7 %) | 48 (10,9 %) | 68 (15,7 %) |
| Huvudvärk | 25 (5,6 %) | 34 (7,6 %) | - | - |
| Övre luftvägsinfektion | 24 (5,4 %) | 18 (4,0 %) | - | - |
| Förhöjt alaninaminotransferas | 8 (1,8 %) | 21 (4,7 %) | 20 (4,5 %) | 26 (6,0 %) |
| Ryggsmärtor | 9 (2,0 %) | 17 (3,8 %) | - | - |
| Förhöjt gammaglutamyltransferas | 2 (0,4 %) | 15 (3,3 %) | 9 (2,0 %) | 25 (5,8 %) |
| Viral luftvägsinfektion | 3 (0,7 %) | 15 (3,3 %) | - | - |
| Urinvägsinfektion | 10 (2,2 %) | 17 (3,8 %) | - | - |
| Hyperkolesterolemi | 5 (1,1 %) | 11 (2,5 %) | - | - |
| Hypertoni | - | - | 14 (3,2 %) | 24 (5,5 %) |
| Faryngit | 5 (1,1 %) | 11 (2,5 %) | - | - |
| Rinit | 3 (0,7 %) | 9 (2,0 %) | - | - |
| Smärtor i övre delen av magen | - | - | 6 (1,4 %) | 14 (3,2 %) |
| Utmattning | - | - | 12 (2,7 %) | 16 (3,7 %) |
| Artralgi | - | - | 6 (1,4 %) | 15 (3,5 %) |
Referenser
- Comi G et al. Lancet Neurol. 2019;18(11):1009–1020.
- Cohen JA et al. Lancet Neurol. 2019;18(11):1021–1033.
- ZEPOSIA® produktresumé, www.fass.se
