Studiedesign
Robust studiedesign med mer än 2,600 patienter i två kliniska fas III-prövningar ¹,²
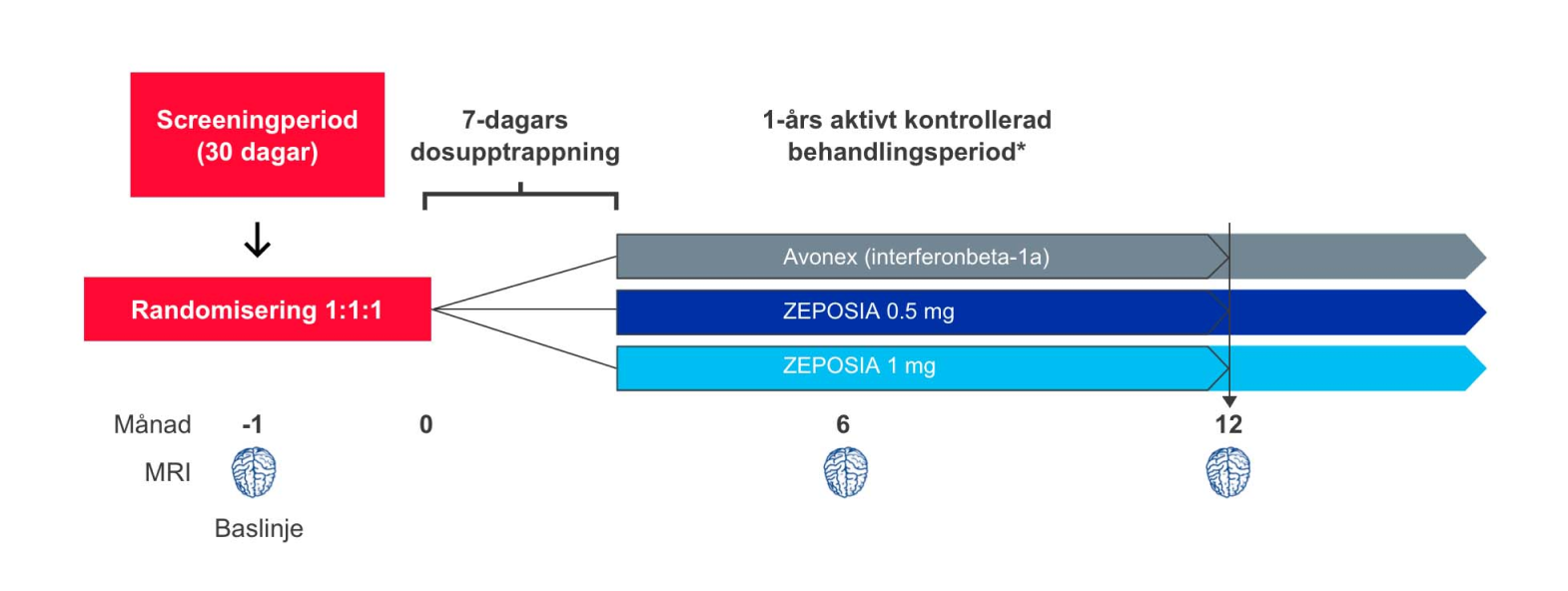
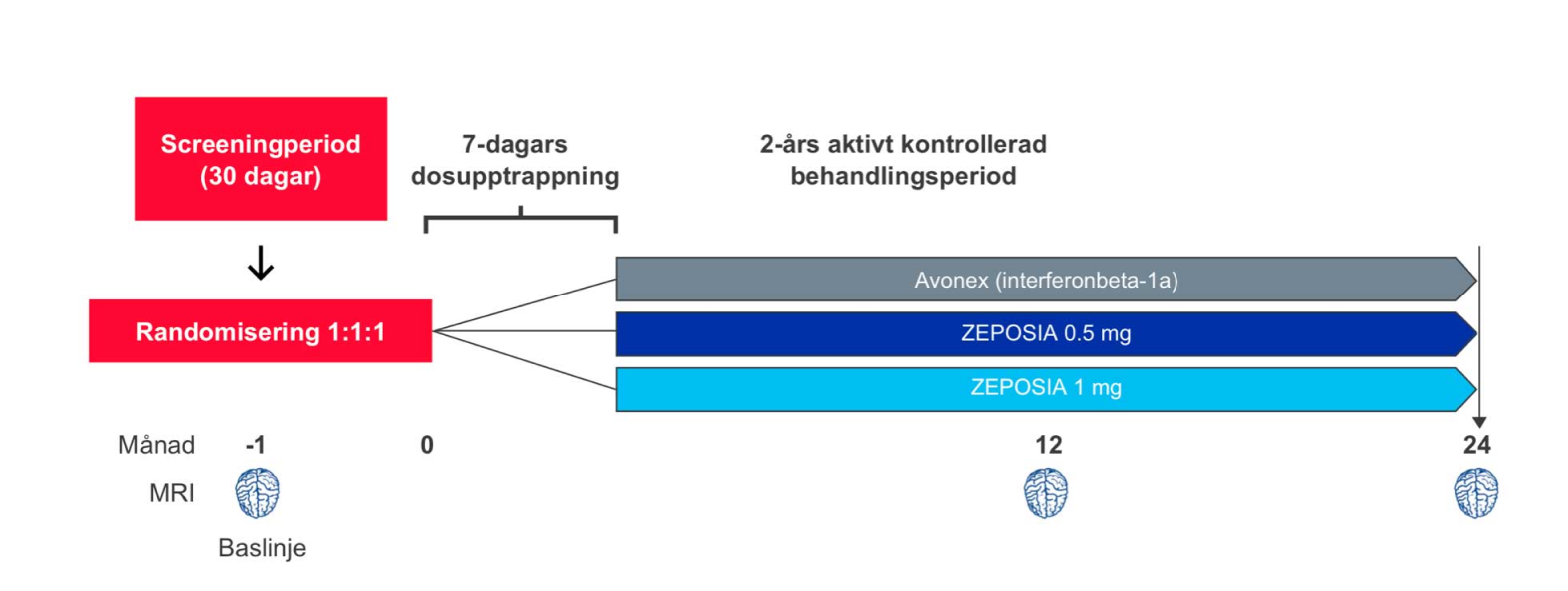
Studiedesign: ZEPOSIA® utvärderades i två randomiserade, dubbelblinda, dubbel-dummy, aktivt kontrollerade kliniska fas III-studier med parallellgrupp med liknande utformning och effektmått, hos patienter med skovvis förlöpande MS (RRMS). I studierna inkluderades sammanlagt mer än 2,600 patienter från 150 centra i över 20 länder.¹,² Studie 1, SUNBEAM, var en 1-årig studie i vilken patienterna fortsatte med den tilldelade behandlingen över 12 månader till dess att den patient som sist inkluderats slutfört studien1. Studie 2, RADIANCE, var en 2-årig studie.²
Dosen av ZEPOSIA® var 0,92 mg (godkänd som underhållsdos) och 0,46 mg som gavs oralt, med en startdos på 0,23 mg under dag 1–4, följt av en upptrappning till 0,46 mg under dag 5–7, följt av den tilldelade dosen från och med dag 8. Dosen av Avonex (interferonbeta 1-a), den aktiva komparatorn, var 30 mikrogram och gavs intramuskulärt en gång i veckan.¹,²
Grundläggande patientkarakteristika: genomsnittsålder 35,5 år (intervall 18–55 år), 67 % var kvinnor och genomsnittlig tid sedan debut av MS-symtom var 6,7 år. Medianpoängen på EDSS-skalan i början av studien var 2,5. Cirka en tredjedel av patienterna hade fått en sjukdomsmodifierande behandling (disease modifying therapy, DMT), huvudsakligen interferon eller glatirameracetat. Vid studiestart var medelantalet återfall under föregående år 1,3 och 45 % av patienterna hade en eller fler T1-Gd-kontrastladdade lesioner (medelvärde 1,7).¹⁻³